|
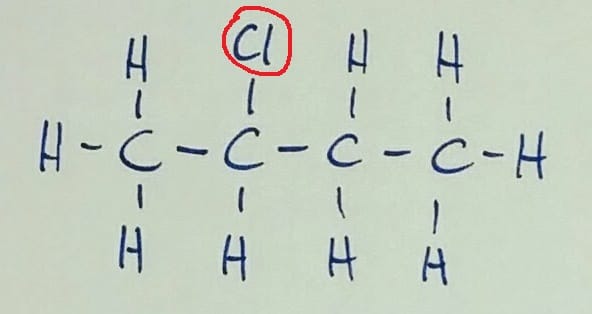
Izomeri imajo enako molekulsko formulo. Položajna izomerija
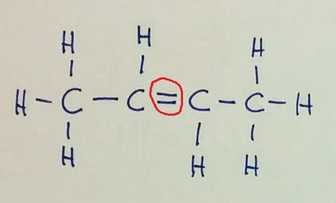
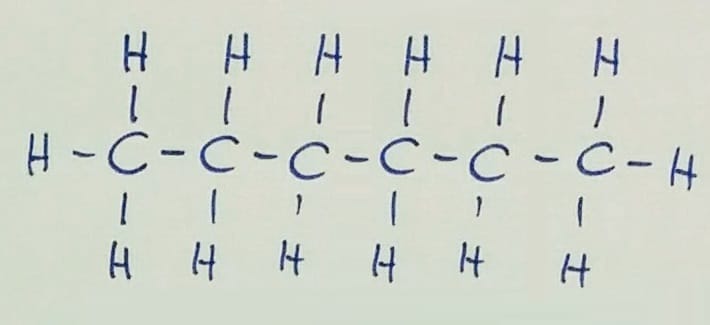
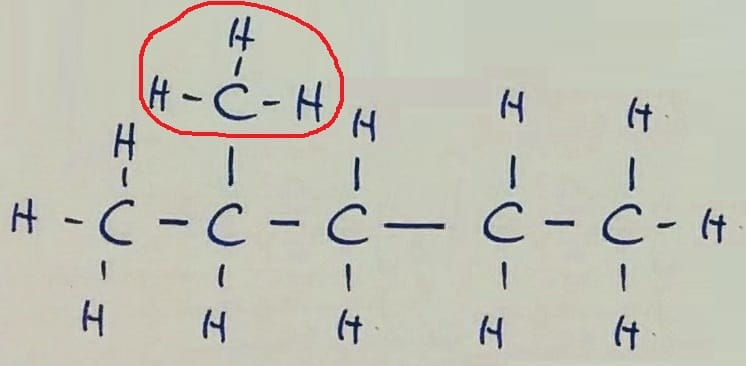
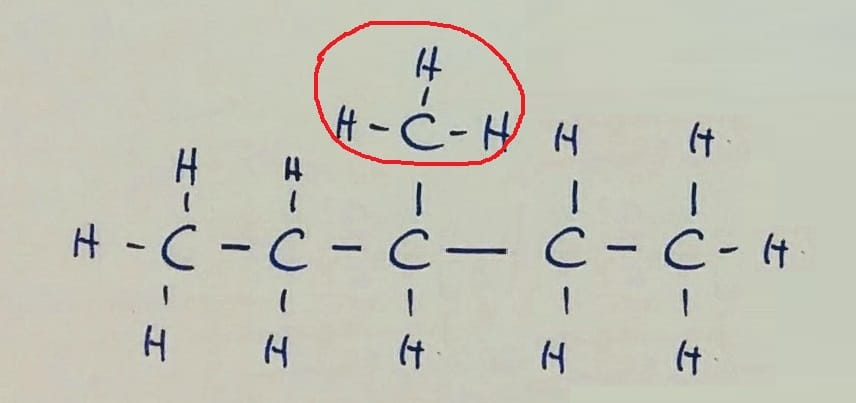
Verižna izomerija Pozor! Na prvi sliki je v glavni verigi 6 ogljikovih atomov, na preostalih dveh pa 5, zato razlika v imenu spojine!
0 Comments
Tole poglavje bom še dopolnil, za začetek pa en hiter nasvet v obliki "kuharskega recepta" :)
Razlaga je najboljša kar na konkretnem primeru. Zapišimo formulo magnezijevega fosfata:
Substitucija pomeni zamenjavo (substitute = angl. "zamenjava"), adicija pa spajanje (addition = angl. "dodajanje, dodatek"). Česa? V prvem primeru atomov oz. skupin atomov (t.i. "funkcionalna skupina") v molekuli, v drugem pa celotnih molekul.
Substitucijo si lahko predstavljamo na primeru dveh skupin ljudi, kjer se na vsaki strani nekdo skrega z ostalimi in se odloči za "prestop". Reaktanta sta dva, prav tako produkta, razlika med njimi pa je ta, da je en element (oz. skupina elementov), ki je bila pred reakcijo v prvi spojini, po reakciji v drugi in obratno. Adicija pa nekako "razbija dvojne in trojne vezi". Zakaj? Zato, ker ima ena izmed spojin pred reakcijo vedno vsaj eno dvojno ali trojno vez, po spajanju z drugo molekulo pa je ta vez samo še enojna oziroma dvojna. To pa zato, ker se tista druga molekula vrine v strukturo prve, to pa lahko stori samo tako, da se prekine ena izmed vezi. Naloge z adicijo najlažje rešimo tako, da na desno stran enačbe ločeno postavimo vse nastopajoče elemente, nato pa med njimi ponovno narišemo (kovalentne) vezi (strukturna formula!). Kakšen primer pa še sledi ;) Da snov prevaja el. tok, mora zadoščati dvem pogojem:
Trdno agregatno stanje:
Raztopine:
Taline:
"Posebneži": Destilirana voda ne prevaja toka, ker ne vsebuje ionov. Grafit tako v trdnem stanju kot v talini prevaja el. tok, čeprav spada med kovalentne kristale Splošno: vse kisline in baze prevajajo električni tok. Kisline v vodnih raztopinah oddajajo vodikove protone, baze pa sprejemajo vodikove protone Pozor! Molekulska vez ni kemijska vez in je zato mnogo šibkejša od kemijskih vezi, med katere štejemo ionske, kovalentne in kovinske vezi! Atomi v posamičnih molekulah, ki tvorijo molekulsko vez, pa so povezani z močnimi kovalentnimi vezmi. Razlika med molekulskim in kovalentnim kristalom je v tem, da so v kovalentnem kristalu atomi povezani direktno v kristal (ne preko molekul). Pri pisanju formul kemijskih reakcij upoštevajte... H₂, N₂, O₂, F₂, Cl₂, Br₂, I₂
Poiščimo formulo pentena. Ker se njegovo ime začne na pent-, nastopajo v njem trije atomi ogljika. Da bi ugotovili še število atomov vodika, moramo narisati njegovo strukturno formulo:
Pri risanju strukturnih formul spojin moramo vsakemu posamičnemu atomu, ki nastopa v spojini, najprej označiti valenčne elektrone. To naredimo na naslednji način:
Pri risanju strukturnih formul si lahko pomagamo z naslednjim "receptom":
Kako iz molekulske formule ugotoviti ime OGLJIKOVODIKA in narisati njegovo strukturno formulo2/3/2016 Podano imamo npr. molekulsko formulo (C3H6). Ker v njej nastopajo trije atomi ogljika, se bo njegovo ime začelo na prop-. Da bi ugotovili še končnico, moramo narisati njegovo strukturno formulo:
Primer 2: Ogljikovodik ima molekulsko formulo C3H8:
Primer 3: Ogljikovodik ima molekulsko formulo C3H4:
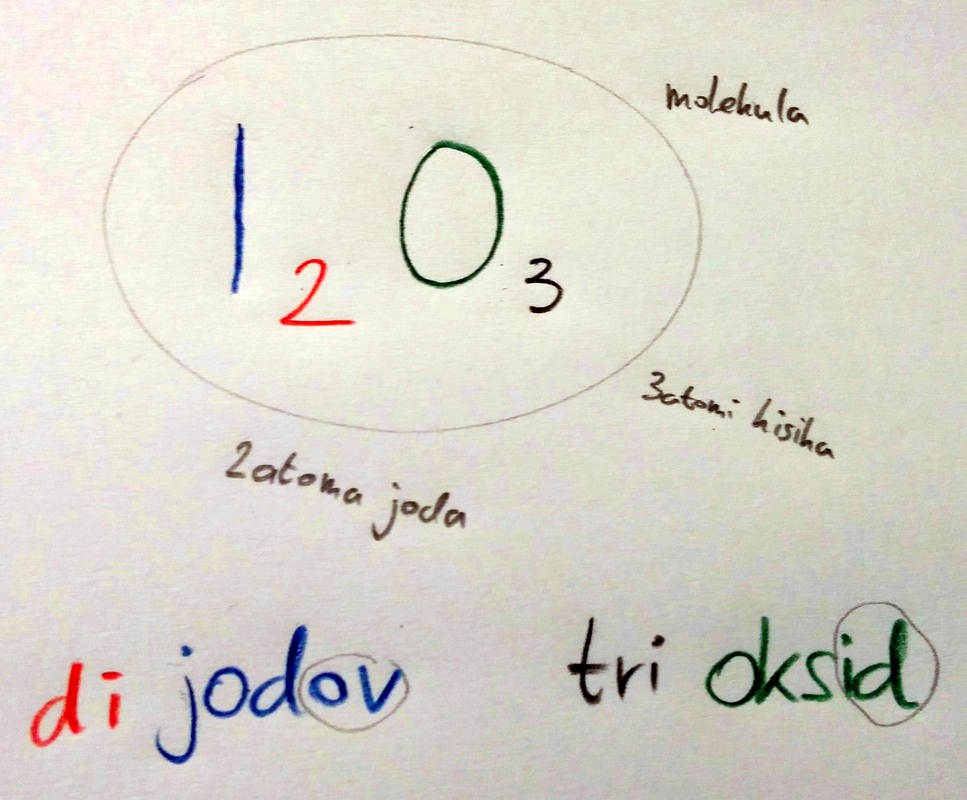
Najprej povejmo, kaj je to binarna spojina. Že sam začetek imena (bi - spomnimo se recimo binomov ali pa binarnih števil) pove, da gre za spojino, ki jo sestavljata dva kemijska elementa (pri tem pa ni pomembno, koliko je v njej atomov posamičnega elementa). Zdaj pa k naši temi. Za primer zapišimo dijodov trioksid: Naše delo s tem še ni končano - pred besedi, ki smo ju zapisali, moramo (po potrebi) dodati še predpono (glej link), ki je odvisna od številke, ki stoji za simbolom posamičnega kemijskega elementa. (rdeča oziroma črna barva na sliki). Ime (binarne) spojine sestoji iz dveh delov:
|
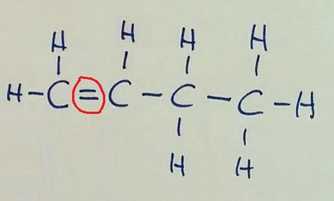
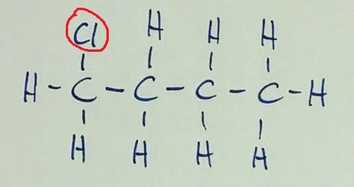

 RSS Feed
RSS Feed
