|
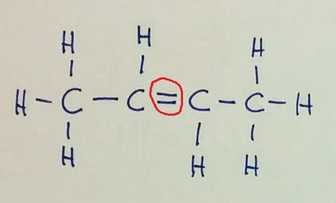
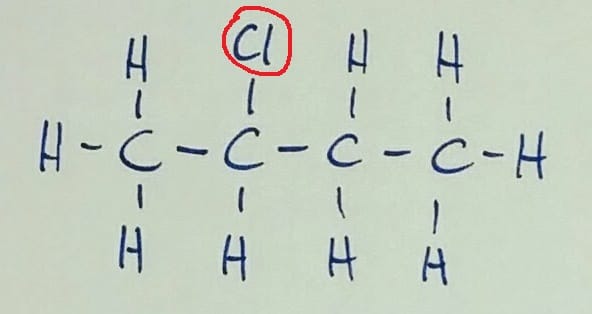
Izomeri imajo enako molekulsko formulo. Položajna izomerija
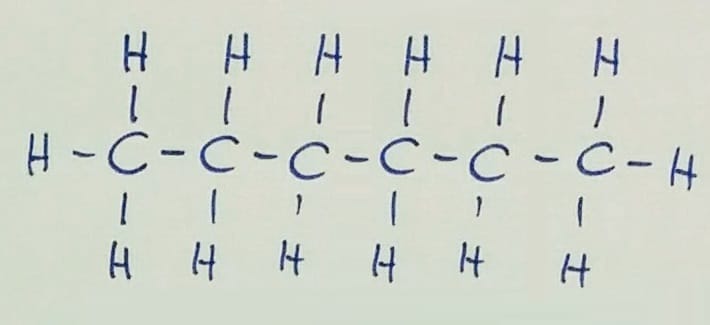
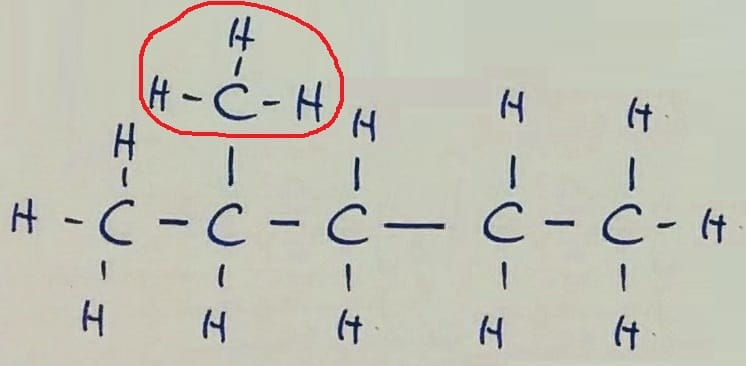
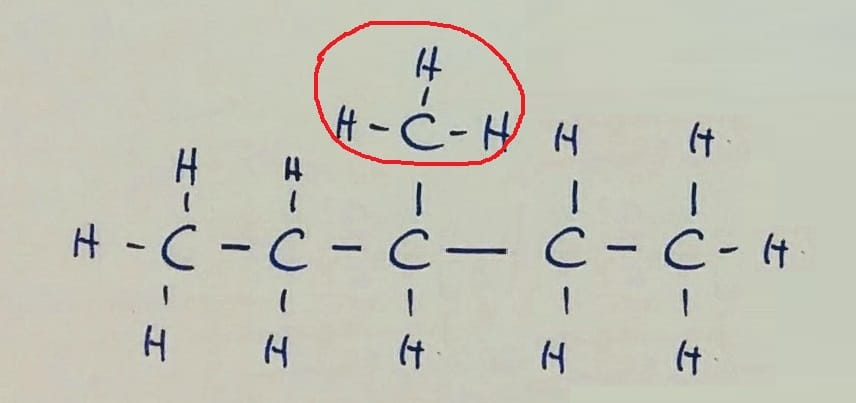
Verižna izomerija Pozor! Na prvi sliki je v glavni verigi 6 ogljikovih atomov, na preostalih dveh pa 5, zato razlika v imenu spojine!
0 Comments
Tole poglavje bom še dopolnil, za začetek pa en hiter nasvet v obliki "kuharskega recepta" :)
Razlaga je najboljša kar na konkretnem primeru. Zapišimo formulo magnezijevega fosfata:
Pri pisanju formul kemijskih reakcij upoštevajte... H₂, N₂, O₂, F₂, Cl₂, Br₂, I₂
Poiščimo formulo pentena. Ker se njegovo ime začne na pent-, nastopajo v njem trije atomi ogljika. Da bi ugotovili še število atomov vodika, moramo narisati njegovo strukturno formulo:
Pri risanju strukturnih formul spojin moramo vsakemu posamičnemu atomu, ki nastopa v spojini, najprej označiti valenčne elektrone. To naredimo na naslednji način:
Pri risanju strukturnih formul si lahko pomagamo z naslednjim "receptom":
Kako iz molekulske formule ugotoviti ime OGLJIKOVODIKA in narisati njegovo strukturno formulo2/3/2016 Podano imamo npr. molekulsko formulo (C3H6). Ker v njej nastopajo trije atomi ogljika, se bo njegovo ime začelo na prop-. Da bi ugotovili še končnico, moramo narisati njegovo strukturno formulo:
Primer 2: Ogljikovodik ima molekulsko formulo C3H8:
Primer 3: Ogljikovodik ima molekulsko formulo C3H4:
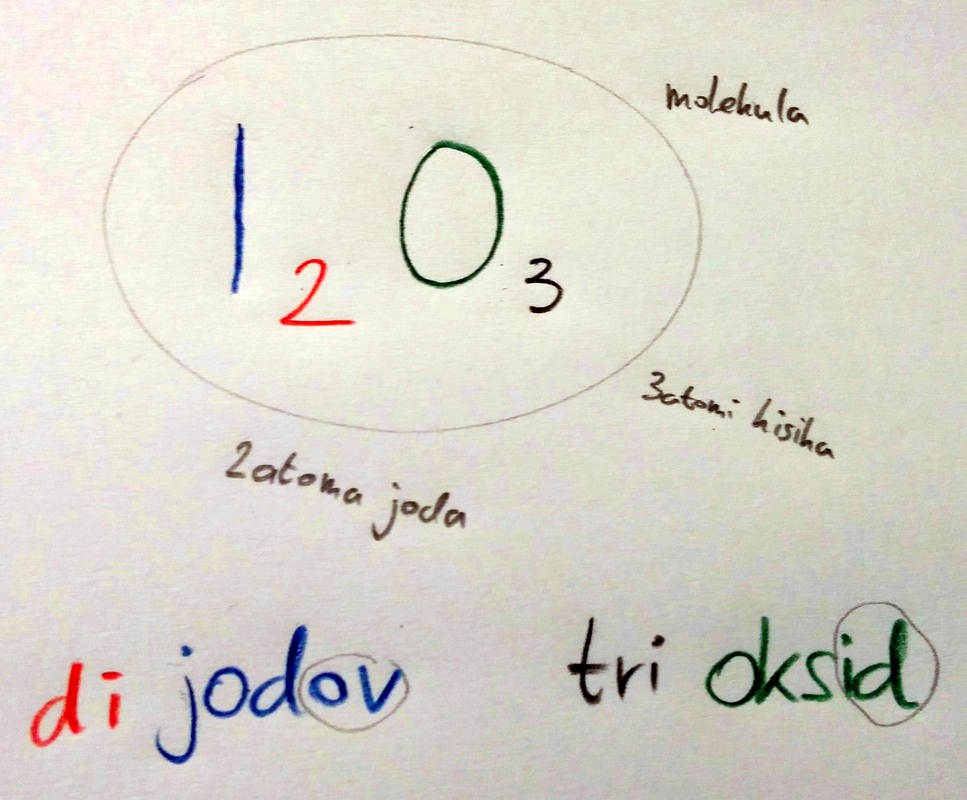
Najprej povejmo, kaj je to binarna spojina. Že sam začetek imena (bi - spomnimo se recimo binomov ali pa binarnih števil) pove, da gre za spojino, ki jo sestavljata dva kemijska elementa (pri tem pa ni pomembno, koliko je v njej atomov posamičnega elementa). Zdaj pa k naši temi. Za primer zapišimo dijodov trioksid: Naše delo s tem še ni končano - pred besedi, ki smo ju zapisali, moramo (po potrebi) dodati še predpono (glej link), ki je odvisna od številke, ki stoji za simbolom posamičnega kemijskega elementa. (rdeča oziroma črna barva na sliki). Ime (binarne) spojine sestoji iz dveh delov:
Najprej razjasnimo, kaj pomeni "urejena kemijska formula". To je formula, ki ima na strani reaktantov ter na strani produktov kemijske reakcije enako skupno število atomov posameznega elementa.
Najhitreje do urejene kemijske formule pridete na naslednji način:
Še nekaj napotkov:
|
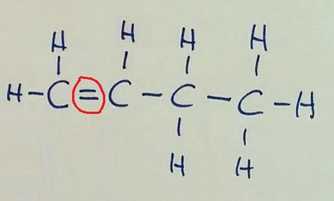
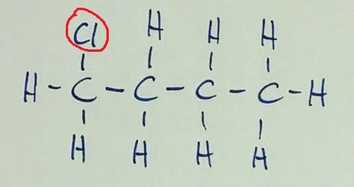

 RSS Feed
RSS Feed
